加藤 靖正 / Yasumasa Kato 教授 [Prof Yasumasa Kato]
担当授業科目
口腔生化学 / Oral Biochemistry (Biochemistry in Dentistry), 生物学 (分子細胞生物学) / Biology (Molecular & Cellular Biology)
主な研究

がん細胞は、好気的条件下でもATP産生の最終産物として乳酸に代謝される解糖系に依存している。そのため、がん組織の細胞外pHは酸性に傾いていることが多い。このような特徴は、ワールブルグ効果(好気的解糖)として広く認識されている。私たちは、ワールブルグ効果によって作られる酸性の細胞外微小環境が細胞に与える影響に着目しています。酸性細胞外微小環境は、様々な因子:例えば、マトリックスメタロプロテアーゼ(MMP9、MMP13)、N-カドヘリン、ビメンチンなどの発現を通じて、がん細胞の浸潤・転移を促進することを見出しています。こちらもご覧ください。
Cancer cells depend on the glycolytic system metabolizing to lactate as the final product for ATP production even under aerobic conditions. Therefore, the extracellular pH of cancer tissue is often acidic. These characteristics are widely recognized as the Warburg effect (aerobic glycolysis). We are focusing the effects of the acidic extracellular microenvironment created by the Warburg effect on cells. We have found that the acidic extracellular microenvironment promotes cancer cell invasion and metastasis through the expression of various factors: e.g., matrix metalloproteinases (MMP9 and MMP13), N-cadherin, vimentin, etc.
高被引用数論文上位5編 (The top 5 highly cited papers) (29 July 2025)
- 引用件数 (Citation): 1170 (Web of Science), 1500(Google Scholar): Kato Y, Ozawa, S, Miyamoto, C, Maehata Y, Suzuki A, Maeda T, Baba Y. Acidic extracellular microenvironment and cancer. Cancer Cell Int 13, 89, 2013. [Pub-Med]. Journal Impact Factor: 6.0
- 引用件数 (Citation): 149 (Scopus), 226(Google Scholar): Kato Y, Lambert CA, Alain CC, Mineur P, Noël A, Frankenne F, Foidart JM, Baba M, Hata R, Miyazaki K, Tsukuda M. Acidic extracellular pH induces matrix metalloproteinase-9 expression in mouse metastatic melanoma cells through the phospholipase D-mitogen-activated protein kinase signaling. J Biol Chem 80(12): 10938-44, 2005. [Pub-Med] Journal Impact Factor: 4.0
- 引用件数 (Citation): 153 (Scopus), 186(Google Scholar): Kato Y, Nakayama Y, Umeda M, Miyazaki K. Induction of 103-kDa gelatinase/type IV collagenase by acidic culture conditions in mouse metastatic melanoma cell lines. J Biol Chem 267(16): 11424–11430, 1992. [Pub-Med]. Journal Impact Factor: 4.0
- 引用件数( (Citation): 96 (Scopus), 135(Google Scholar): Kato Y, Ozawa S, Tsukuda M, Kubota E, Miyazaki K, St-Pierre Y, Hata RI. Acidic extracellular pH increases calcium influx-triggered phospholipase D activity along with acidic sphingomyelinase activation to induce matrix metalloproteinase-9 expression in mouse metastatic melanoma. FEBS J 274(12): 3171-3183, 2007. [Pub-Med]. Journal Impact Factor: 4.2
- 引用件数 (Citation): 94 (Web of Science), 133(Google Scholar): Kato Y, Maeda T, Suzuki A, Baba Y. Cancer metabolism: New insights into classic characteristics. Jpn Dent Sci Rev 54(1), 8-21, 2018. [Pub-Med]. Journal Impact Factor: 6.6
お知らせ
- Frontiers in Oncology誌のAssociate Editor (Cancer Metabolismセクション)に就任しました。2025年11月15日
- 第98回日本生化学会大会(京都)にて発表しました。2025年11月3日(月)~5日(水) 日本生化学会は設立100年を迎えました。
- 第67回歯科基礎医学会学術大会(北九州)にて発表しました。2025年9月5日(金)~7日(日)
- Cancer Cell International (IF2024: 6.0)に2013年発表の論文が被引用件数1500(GoogleScolar)に達しました。2025年7月29日(火)
- 一般社団法人 日本がんと炎症・代謝研究会 第11回学術集会(京都)にて招待講演を行いました。2025年6月28日(土)
- 第34回日本がん転移学会学術集会・総会にて発表しました。2025年6月19日(木)~20日(金)
- 第91回日本生化学会東北支部例会・シンポジウムにて発表しました。2025年6月14日(土)
研究
業績(References): 2010-Present
(1) Peer-reviewed/invited papers
- Kato Y and Mawatari K. Clinical significance of acidic extracellular microenvironment modulated genes. Front Oncol 14 - 2024. doi: 10.3389/fonc.2024.1380679 [Pub-Med]
- 川嶋雅之, 前田豊信, 御代田 俊, 小嶋忠之, 加藤靖正, 高田 訓. マウスB16-BL6細胞における酸性細胞外pH誘導性MMP-9発現誘導経路に対するPAK6/7の役割. 日本口腔外科学会雑誌 70(9), 2024. (in Japanese)
- Kobayashi-Sakamoto M, Maeda T, Yusa J, Shimada T, Tani H, Kato Y, Hirose K. Bovine lactoferrin suppresses the cathepsin-dependent pathway of SARS-CoV-2 entry in vitro. Int Dairy J 148, 105805, January 2024. doi: 10.1016/j.idairyj.2023.105805 [Publisher site]
- Kanamori K, Ozawa S, Iwabuchi H, Ikoma T, Suzuki K, Tanaka K, Yoshimura Sawai N, Abe T, Kato Y, Hata RI, Kobayashi M. GPRC5B (G protein-coupled receptor class C group 5 member B) suppresses glucose starvation-induced apoptosis in head-and-neck squamous cell carcinoma. Biomed Res 44(1):1-7, 2023. doi: 10.2220/biomedres.44.1 [Pub-Med]
- Hatori T, Maeda T, Suzuki A, Takahashi K, Kato Y. SPARC is a decoy counterpart for c‑Fos and is associated with osteoblastic differentiation of bone marrow stromal cells by inhibiting adipogenesis. Mol Med Rep 27(2): 50, 2023. doi: 10.3892/mmr.2023.12937 [Pub-Med]
- Takahashi K, Yamazaki K, Yamazaki M, Kato Y, Baba Y. Personalized medicine based on the pathogenesis and risk assessment of endodontic–periodontal lesions. J Pers Med 12(10): 1688. doi: 10.3390/jpm12101688 [Pub-Med]
- Baba Y, Kato Y, Takahashi K. Acute bacterial epiglottitis and COVID-induced angioedema of the larynx are possible differential diagnoses. Intern Med. Online ahead of print. doi: 10.2169/internalmedicine.0809-22 [Pub-Med]
- Furuya G, Katoh H, Atsumi S, Hashimoto I, Komura D, Hatanaka R, Senga S, Hayashi S, Akita S, Matsumura H, Miura A, Mita H, Nakakido M, Nagatoishi S, Sugiyama A, Suzuki R, Konishi H, Yamamoto A, Abe H, Hiraoka N, Aoki K, Kato Y, Seto Y, Yoshimura C, Miyadera K, Tsumoto K, Ushiku T, Ishikawa S. Nucleic Acid-triggered Tumoral Immunity Propagates pH-selective Therapeutic Antibodies through Tumor-driven Epitope Spreading. Cancer Sci, 2022 Sep 22. doi: 10.1111/cas.15596. Online ahead of print [Pub-Med]
- Baba Y, Kato Y, Takahashi K. Proposal for a paradigm shift in personalized medicine for patients with a maxillary edentulous jaw by ENT specialist and dentist cooperation. J Pers Med 12(8): 1289. doi: 10.3390/jpm12081289 [Pub-Med]
- Kobayashi-Sakamoto M, Maeda T, Kimura M, Yusa J, Ito H, Tani H, Kato Y, Hirose K. Bovine lactoferrin increases the poly(I:C)-induced antiviral response in vivo. Biochem Cell Biol 100(4): 338-348. doi: 10.1139/bcb-2021-0342 [Pub-Med]
- Baba Y, Takada S, Kato Y. In reference to risk perception of septic shock with multiple organ failure due to acute exacerbation of an infectious dental disease. Ther Clin Risk Manag 17: 1163-1164, 2021. doi: 10.2147/TCRM.S342486 [Pub-Med]
- Funakawa T, Kawanabe H Usami A, Takahashi K, Kato Y, Baba Y. The importance of early detection for postoperative maxillary cyst before dental implantation: A case report. Int J Surg Case Rep 86: 106370, 2021. doi: 10.1016/j.ijscr.2021.106370 [Pub-Med]
- Baba Y, Kato Y. Letter to the Editor: In reference to COVID-19 and the otolaryngologist: preliminary evidence-based review. Laryngoscope 131: E1460, 2021. doi: 10.1002/lary.29412 [Pub-Med]
- Baba Y, Takada S, Segawa H, Kato Y. Different management between emergent infectious diseases and emergent non-infectious diseases during COVID-19 pandemic in a head and neck unit. Braz J Infect Dis S1413-8670(20), 30106–301069, 2020. doi: 10.1016/j.bjid.2020.07.007 [Pub-Med]
- Kojima T, Maeda T, Suzuki A, Yamamori T, Kato Y. Intracellular zinc-dependent TAS2R8 gene expression through CTCF activation. Biomed Res (Tokyo) 41 (5), 217–225, 2020. doi: 10.2220/biomedres.41.217 [Pub-Med]
- Suzuki-Yamazaki M, Takahashi K, Takada S, Kato Y, Baba Y. A successful treatment regimen for the prevention of sinusitis after maxillary sinus floor elevation surgery in a high-risk case. Case Rep Otolaryngol 2020, 6869805, 2020. doi: 10.1155/2020/6869805 [Pub-Med]
- Kobayashi-Sakamoto M, Maeda T, Yusa J, Kato Y, Kiyoura Y. RANK-RANKL signaling upregulates Il-10 mRNA expression in mucosal Candida infection in vivo. Microb Pathog 149, 104285, 2020. doi: 10.1016/j.micpath.2020.104285 [Pub-Med]
- Baba Y, Kato Y. Letter to the Editor (Confusion of epipen trainer with epipen caused by a pharmacist). J Paediatr Child Health 56(5), 826-827, 2020. doi: 10.1111/jpc.14884 [Pub-Med]
- Sutoo S, Maeda T, Suzuki A, Kato Y. Adaptation to chronic acidic extracellular pH elicits a sustained increase in lung cancer cell invasion and metastasis. Clin Exp Metastasis 37(1), 133-144, 2020. doi: 10.1007/s10585-019-09990-1[Pub-Med]
- Nagaoka M, Maeda T, Chatani M, Handa K, Yamakawa T, Kiyohara S, Negishi-Koga T, Kato Y, Takami M, Niida S, Lang SC, Kruger MC, Suzuki K. A Delphinidin-Enriched Maqui Berry Extract Improves Bone Metabolism and Protects against Bone Loss in Osteopenic Mouse Models. Antioxidants (Basel) 8(9), E386, 2019. doi: 10.3390/antiox8090386 [Pub-Med]
- Nagaoka M, Maeda T, Moriwaki S, Nomura A, Kato Y, Niida S, Kruger MC, Suzuki K.. Petunidin, a B-ring 5'-O-methylated derivative of delphinidin, stimulates osteoblastogenesis and reduces sRANKL-induced bone loss. Int J Mol Sci 20(11), 2795, 2019. doi: 10.3390/ijms20112795 [Pub-Med]
- 渡部敏恵,衛藤雅昭,小池勇一,佐藤 研,加藤靖正,馬場 優. 4種ウイルス感染症における抗体陽性率および感受性率の年次推移について-麻疹・風疹・ムンプス・水筒の血清抗体価解析-. Campus Health 56(2), 104-110, 2019. doi: 10.18632/oncotarget.20826 [Publisher site] (in Japanese)
- Zijlstra A, Von Lersner A, Yu D, Borrello, B, Oudin M, Kang Y, Sahai E, Fingleton B, Stein U, Cox T, Price J, Kato Y, Welm A, Aguirre-Ghiso J. The importance of developing therapies targeting the biological spectrum of metastatic disease. Clin Exp Metastasis 36(4), 305–309, 2019. doi: 10.1007/s10585-019-09972-3 [Pub-Med]
- Sumida R, Maeda T, Kawahara I, Yusa J, Kato Y. Platelet?rich fibrin increases the osteoprotegerin/receptor activator of nuclear factor?κB ligand ratio in osteoblasts. Exp Ther Med, 2019. doi: https://doi.org/10.3892/etm.2019.7560 [Publisher site]
- Yang XY, Ozawa S, Kato Y, Maehata Y, Izukuri K, Ikoma T, Kanamori K, Akasaka T, Suzuki K, Iwabuchi H, Kurata SI, Katoh I, Sakurai T, Kiyono T, Hata RI. C-X-C Motif Chemokine Ligand 14 is a Unique Multifunctional Regulator of Tumor Progression. Int J Mol Sci 20(8), E1872, 2019. doi: 10.3390/ijms20081872 [Pub-Med]
- Kato Y, Maeda T, Suzuki A, Baba Y. Cancer metabolism: New insights into classic characteristics. Jpn Dent Sci Rev 54(1), 8-21, 2018. doi: 10.1016/j.jdsr.2017.08.003 [Pub-Med]
- Baba Y, Kato Y. Deguelin, a novel anti-tumorigenic agent in human esophageal squamous cell carcinoma. EBioMedicine 26(10), 10, 2017. doi: 10. doi: 10.1016/j.ebiom.2017.11.010 [Pub-Med]
- Fingleton B, Lange K, Caldwell B, Bankaitis KV; Board of the Metastasis Research Society (Kang Y, Yu D, Aguirre-Ghiso J, Cox TR, Erler JT, Gelman IH, Hurst DR, Kato Y, Lynch CC, Price JT, Samant RS, Sleeman J, Stein U, Zijlstra A). Perspective on the interpretation of research and translation to clinical care with therapy-associated metastatic breast cancer progression as an example. Clin Exp Metastasis 34(8), 443-447, 2017. doi: 10.1007/s10585-017-9872-8 [Pub-Med]
- Maeda T, Suzuki A, Koga K, Miyamoto C, Maehata Y, Ozawa S, Hata RI, Nagashima Y, Nabeshima K, Miyazaki K, Kato Y. TRPM5 mediates acidic extracellular pH signaling and TRPM5 inhibition reduces spontaneous metastasis in mouse B16-BL6 melanoma cells. Oncotarget 8(45), 78312-78326, 2017. doi: 10.18632/oncotarget.20826 [Pub-Med]
- Baba Y, Kato Y. Promising biomarkers to predict the efficacy of inhibitors of the epidermal growth factor receptor tyrosine kinase in head and neck squamous cell carcinoma. Biomarkers J 3:6, 2017. doi: 10.21767/2472-1646.100028 [Publisher site]
- Baba Y, Maeda T, Suzuki A, Takada S, Fujii M, Kato Y. Deguelin Potentiates Apoptotic activity of an EGFR tyrosine kinase inhibitor (AG1478) in PIK3CA-mutated head and neck squamous cell carcinoma. Int J Mol Sci 18(2), E262, 2017. doi: 10.3390/ijms18020262 [Pub-Med]
- Maeda T, Yuzawa S, Suzuki A, Baba Y, Nishimura Y, Kato Y. RhoA mediates the expression of acidic extracellular pH-induced matrix metalloproteinase-9 mRNA through phospholipase D1 in mouse metastatic B16-BL6 melanoma cells. Int J Oncol 48(3), 1251-1257, 2016. doi: 10.3892/ijo.2016.3322 [Pub-Med]
- Baba Y, Kato Y. The role of bevacizumab in the management of head and neck squamous cell carcinoma patients. Chemotherapy 4(3); 1000163, 2015. doi: 10.4172/2167-7700.1000163 [Publisher site]
- Maeda T, Suzuki A, Yuzawa S, Baba Y, Kimura Y, Kato Y. Mineral trioxide aggregate induces osteoblastogenesis via Atf6. Bone Rep 2, 36-43, 2015. doi:10.1016/j.bonr.2015.03.003 [Pub-Med]
- Nishiyama T, Kato Y, Baba Y. Nasopharyngeal leiomyomatous hamartoma: case report. BMC Ear Nose Throat Disord 14: 5, 2014. doi: 10.1186/1472-6815-14-5 [Pub-Med]
- Kobayashi R, Terakawa J, Kato Y, Azimi S, Inoue N, Ohmori Y, Hondo E. The contribution of leukemia inhibitory factor (LIF) for embryo implantation differs among strains of mice. Immunobiology 219(7): 512-21, 2014. doi: 10.1016/j.imbio.2014.03.011 [Pub-Med]
- Hata R, Izukuri K, Kato Y, Sasaki S, Mukaida N, Maehata Y, Miyamoto C, Akasaka T, Yang X, Nagashima Y, Takeda K, Kiyono T, Taniguchi M. Suppressed rate of carcinogenesis and decreases in tumour volume and lung metastasis in CXCL14/BRAK transgenic mice. Sci Rep 5, 9083, 2015. doi:10.1038/srep09083 [Pub-Med]
- Suzuki A, Maeda T, Baba Y, Shimamura K, Kato Y. Acidic extracellular pH promotes epithelial mesenchymal transition in Lewis lung carcinoma model. Cancer Cell Int, 2014, 14: 129. doi:10.1186/s12935-014-0129-1 [Pub-Med]
- Baba Y, Fujii M, Maeda T, Suzuki A, Yuzawa S, Kato Y. Deguelin induced apoptosis by targeting both EGFR-Akt and IGF1R-Akt pathways in head and neck squamous cell cancer cell lines. BioMed Res Int 657179, 2014. doi: 10.1155/2015/657179 [Pub-Med]
- Kato Y, Ozawa, S, Miyamoto, C, Maehata Y, Suzuki A, Maeda T, Baba Y. Acidic extracellular microenvironment and cancer. Cancer Cell Int 13, 89, 2013. [Pub-Med]
- Baba Y, Kato Y. Hemangioma with phleboliths in the floor of the mouth presenting as a submental swelling: a case report. J Med Cases 2(1): 28-30, 2011. [Publisher site]
- Baba Y, Kato Y, Ogawa K. Unusual computed tomography findings of radionecrosis after chemoradiation of stage IV hypopharyngeal cancer: a case report. J Med Case Rep 5(1): 25, 2011. [Pub-Med]
- Baba Y, Kato Y, Ogawa K. Hyperplasia of lymphoid structures in the hypopharynx: a case report. J Med Case Rep 4: 388, 2010. [Pub-Med]
- Nakazaki K, Kato Y, Taguchi T, Inayama Y, Ishiguro Y, Tsukuda M. Heterozygous mutation (G/G→G/A) at nt 2607 of the EGFR gene is closely associated with increases in EGFR copy number and mRNA half life, but impaired EGFR protein synthesis in squamous cell carcinomas of the head and neck - implication for gefitinib efficacy. Oncol Lett 1: 1017-1020, 2010. [Pub-Med]
- Maehata Y, Ozawa S, Kobayashi K, Kato Y, Yoshino F, Miyamoto C, Izukuri K, Kubota E, Hata RI, Lee MC. Reactive oxygen species (ROS) reduce the expression of BRAK/CXCL14 in human head and neck squamous cell carcinoma cells. Free Radical Res 44(8): 913-924, 2010. [Pub-Med]
- Ozawa S, Ito S, Kato Y, Kubota E, Hata RI. Human p38delta MAP kinase mediates UV irradiation induced up-regulation of the gene expression of chemokine BRAK/CXCL14. Biochem Biophys Res Commun 396(4) 1060-1064, 2010. [Pub-Med]
- Komori R, Ozawa S, Kato Y, Shinji H, Kimoto S, Hata RI. Functional characterization of proximal promoter of gene for human chemokine BRAK/CXCL14. Biomed Res 31(2): 123-131, 2010. [Pub-Med]
- Sato K, Ozawa S, Izukuri K, Kato Y, Hata RI. Expression of tumor-suppressing chemokine BRAK/ CXCL14 reduces cell migration rate of HSC-3 tongue carcinoma cells and stimulates attachment to collagen and formation of elongated focal adhesions in vitro. Cell Biol Int 34: 513-522, 2010. [Pub-Med]
- Baba Y, Kato Y, Ogawa K. Inostamycin prevents malignant phenotype of cancer: inhibition of phosphatidylinositol synthesis provides a therapeutic advantage for head and neck squamous cell carcinoma. Cell Biol Int 34(2):171-175, 2010. [Pub-Med]
(2) Books in Japanese
- 加藤靖正.第1章 生化学に必要な化学の基礎,第15章 癌の生化学,In: スタンダード生化学・口腔生化学第4版(編集・執筆:荒川俊哉,池尾 隆,加藤靖正,古株彰一郎,近藤信夫,自見英治郎,鈴木直人,半田慶介,坂東健二郎,平塚浩一;執筆:川木晴美,高井理衣,髙田鮎子,髙山英次,田邉奈津子,津田啓方,堂前英資,藤田 厚,吉川美弘; ISBN: 978-4-7624-3633-8), 学研書院, 東京, p.2-11; 318-331, 2023. [Publisher site]
- 馬場 優, 高田 訓, 加藤靖正.口腔癌におけるEGFR阻害剤の効果予測因子. BIO Clinica 34(9), 39-41, 2019. [Publisher site]
- 加藤靖正,前田豊信,鈴木厚子.酸性細胞外pH:がん転移に関連する微小環境. 細胞 50(5), 32-36, 2018.[Publisher site]
- 加藤靖正.第2章 がんはどうしてできるか,In: 口腔生化学第6版(監修:早川太郎、須田立雄、木崎治俊; ISBN: 978-4-263-456-45-3),医歯薬出版,東京,p. 301-338, 2018. [Publisher site]
(3) Books in English
- Baba Y, Nishiyama T, Kato Y. Diagnosis and treatment of accessory parotid gland tumors, In: International manual of oncology practice (Eds: de Mello RA, Tavares A, Mountzios G; ISBN: 978-3-319-21682-9), Springer, Cham, Switzerland, p.123-140, 2012. doi: 10.1007/978-3-319-21683-6 [Publisher site]
- Baba Y, Fujii M, Tokumaru Y, Kato Y. Overcoming resistance to EGFR inhibitor in head and neck cancer (Chapter 1), In: The research and biology of cancer II (Eds: Shoja MM, Agutter PS, Tubbs RS, Ghanei M, Ghabili K, Harris A, Loukas M; ISBN: 978-14775549-9-9), iConcept Press, Hong Kong, China, p.1-18, 2012.
- Baba Y, Fujii M, Tokumaru Y, Kato Y. A proposal for a new strategy in head and neck cancer: combination therapy targeting the PI3kinase/Akt and EGFR signaling pathways (Chapter 12), In: Hypothesis in clinical medicine (Eds: Shoja MM, Agutter PS, Tubbs RS, Ghanei M, Ghabili K, Harris A, Loukas M; ISBN: 978-1-62257-285-4), Nova Science Publishers, New York, USA, p.181-198, 2012. [Publisher site]
- Baba Y, Fujii M, Tokumaru Y, Kato Y. Cell Signalings and the Communications in Head and Neck Cancer, In: Head and Neck Cancer (Ed: Agulnik, M; ISBN: 978-953-51-0236-6), InTech, Rijeka, p.123-140, 2012. [Publisher site]
所属学会・団体名
その他
【特許】
| 発明の名称 |
頚部癌抑制剤および医薬組成物 |
骨形成促進剤及び骨形成促進装置 |
| 発明者 |
畑隆一郎,加藤靖正,小澤重幸,久保田英朗 |
加藤靖正,前田豊信,鈴木厚子,藤山敬至,塩沢亜弥 |
| 出願日 |
2005年9月20日 |
2015年10月28日 |
| 出願番号 |
特願2005-271397 |
特願2015-212328 |
| 登録日 |
2011年8月19日 |
2019年11月15日 |
| 特許番号 |
4805641 |
6614916 |
癌に対する治療は、外科的切除や放射線照射による根治的治療法の他、新しい抗癌剤の開発などにより、局所における癌のコントロールは良好になってきていますが、残念ながら遠隔に転移した癌に対しては効果的な治療法は確立されていません。このようなことから癌細胞の転移の阻止は、癌の治療において最重要課題といえます。
では、癌細胞の転移とはどのようにして成立するのでしょうか。
癌細胞の転移といっても複雑な過程を経て成立します。すなわち、原発巣での癌細胞の増殖、血管への侵入、遠隔部位への移動、標的臓器内での着床、脈管系からの脱出、転移巣の形成です(図1)。リンパ節転移も基本的には同様に考えられています。
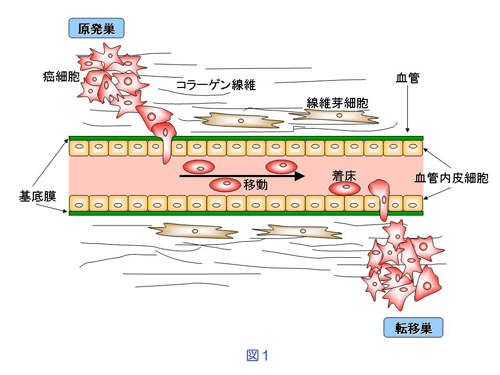
ここで、血管の構造(図1)について簡単に説明しますと、血流に接しているのは血管内皮細胞ですが、血管内皮細胞はIV型コラーゲンを主成分として形成されている基底膜と呼ばれる構造の上に整然と並んでいます。コラーゲンには複数のタイプがあり生体のどこにでもあるコラーゲンはⅠ型ですが、これは基底膜には存在していません。Ⅰ型に代わって、基底膜を構成しているコラーゲンはⅣ型であり脈管のバリヤーとしても機能しています。従って、脈管系の出入りの際には必ず通過することになる基底膜の破壊と通過の過程は、癌細胞の転移の律速段階と考えられています。コラーゲンの種類により効率よく分解できる酵素が異なるため、Ⅳ型コラーゲンを特異的に分解できる酵素の分泌・活性化が癌細胞の転移能を規定する重要な能力といえます。この概念は、1980年、L. A. Liottaらによって証明されました。すなわち、実験動物に培養癌細胞を移植したときに転移性が高いあるいは低いことが示された癌細胞をⅣ型コラーゲン上で培養すると、転移性の高い細胞ほどⅣ型コラーゲンが融解するという実験です。
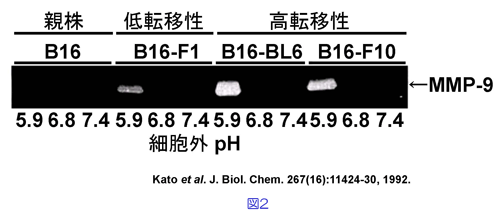
私たちは、このとき用いられた癌細胞を入手し、先の実験でⅣ型コラーゲンの分解を担った酵素の分子種がmatrix metalloproteinase-9 (MMP-9)であったことを同定するとともに、細胞外pHの低下によりMMP-9合成が誘導されるという新たな機構を発見しました(図2,文献1,2)。
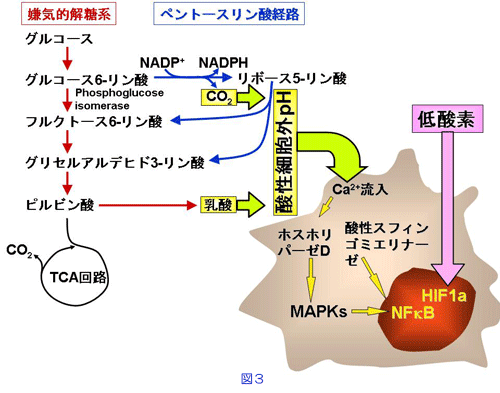
一般に、細胞はホルモンや増殖因子などによって刺激を受けると種々のタンパク質の合成が上昇しますが、細胞外のpHの低下による刺激によってタンパク質の合成が制御される機構については、ほとんど分かっていませんでした。そこで、私たちはその機構について詳細に検討してみると、細胞膜を構成しているリン脂質の代謝酵素であるホスホリパーゼDの活性化が重要であることを見出しました。その刺激は、ERKやp38 MAPKのようなキナーゼ(リン酸化酵素)を活性化し、さらにNFκBという転写因子の活性化を通じてMMP-9のタンパク質合成を促進していることを突き止めました。さらに、ホスホリパーゼDの活性化には、細胞外からのカルシウムの流入が必須なこと、また、別のリン脂質の代謝酵素である酸性スフィンゴミエリナーゼの活性化などが関与していることも見出しました(図3, 文献3,4)。
最近、細胞外pHに対する感受性を上昇する因子を見出し、遺伝子改変技術をもちいて癌細胞自身の酸性pHに対する感受性を上昇させることで、転移能が亢進することを、マウスを用いた研究で明らかとなりました。
私たちの体の中のpHは、およそ7.4付近に厳密に制御されていますので、癌細胞が酸性pHにさらされることがありえるのだろうかという疑問をお持ちの方も多いと思います。胃液のpHが低いことはよく知られていますが、これ以外にも、実は局所におけるpHの低下はあちこちで見られます。骨粗鬆症などでは破骨細胞によって骨が溶解するのですが、このときの骨の溶解は破骨細胞が分泌する酸によって行われています。また、細菌感染のときに見られる炎症部位や皮膚表面も酸性pHを示しており、細菌感染に対する防御機構の一つとして働いています。癌細胞では、糖代謝によって産生される乳酸によって癌組織内のpHが低下するだけでなく、グルコース代謝の過程(ペントースリン酸経路)で二酸化炭素の分泌が亢進し、これによりpHが低下することもあります(図3)。
乳酸は、運動をたくさん行ったときの疲労物質として知られていますが、乳酸のもとはグルコースなのです。癌細胞が血管から遠ざかると血管からの酸素が届かなくなり低酸素状態になります。癌細胞は増殖力が旺盛であるため、すぐに既存の血管から遠ざかってしまいますが、癌細胞は酸素が十分に供給されていてもエネルギー産生に酸素を必要としてない経路、つまり嫌気的解糖系によりエネルギーを得ていますので、癌細胞のエネルギー産生に関しては、周囲の環境の影響を受けにくくなっています。むしろ低酸素に反応して、嫌気的解糖系を構成している代謝酵素の合成量が上昇することにより効率よく代謝を行える仕組みを持っているのです。乳酸は、嫌気的解糖系による代謝産物であり、癌細胞では恒常的に酸を分泌しているので、組織のpHが低下するという仕組みです。
実は、癌組織の細胞外pHが低下することは古くから知られていたのですが、局所の酸性pHによる影響で癌細胞自身の悪性形質が維持されているという機構については、これまであまり重要視されず、不明な点が多く残されています。局所での酸性pH刺激による癌細胞の悪性形質の発現機構を明らかにすることは、その経路を遮断する手段により遠隔転移などの癌細胞の悪性形質を抑制する新しい治療法の開発につながるため、重要な研究といえます。
参考文献
- Kato, Y. et al., J. Biol. Chem. 267(16): 11424-11430, 1992.
- Kato, Y. et al., Cell Biol Int. 20(5): 375-377, 1996.
- Kato, Y. et al., J. Biol. Chem. 280(12): 10938-10944, 2005.
- Kato, Y. et al., FEBS J. 274(12): 3171-3183, 2007.
図2の解説
ポリアクリルアミドゲルとよばれる網目の中を通電すると、タンパク質は+極に向かって移動します。この時、分子の大きいものは、網目に引っかかるため移動が遅く、分子の小さいものは容易に移動するため、いろいろな分子のものが混在した中から分子の大きさに応じて分離する方法が、ポリアクリルアミドゲル電気泳動と呼ばれる分析法です。これを応用した実験方法にザイモグラフィー法があります。図2はその実験結果を示しています。ゲル全体にゼラチンを混ぜたポリアクリルアミドゲルを用いてタンパク質を分子の大きさに応じて分離した後、37度で1晩反応させ、タンパク質を染色する試薬(クマシーブリリアントブルーR250)で染色すると、ゲル全体にあるゼラチンは青く染色されますが、ゼラチンを分解する酵素があるところは、色が染まらず白く透き通ったバンドとして検出される方法です(図のオリジナルは青白ですが、白黒写真に変換してあるので青い部分は黒くなっています)。



 Grants-in-Aid for Scientific Research(KAKEN)
Grants-in-Aid for Scientific Research(KAKEN)

