
研究紹介


薬物送達システム(ドラッグ・デリバリー・システム、DDS)とは、医薬品を必要な場所に、必要な時間、必要な量だけ送達する技術です。一般的に薬を飲んだとき、有効成分が患部までたどり着き、効き目を発揮するのは、飲んだ量のわずか1/100~1/10,000程度に過ぎません。また、その飲んだ薬が必要のない場所に作用したばかりに、副作用を引き起こすこともあります。
DDSとは、薬のこうした欠点を克服するための技術です。そしてDDSによって、投与する薬の量や投与回数を減らすことや副作用を軽減させることが可能となり、患者様の負担が大きく軽減されると考えられます。
効果的なDDSを開発するためには、刺激応答型薬物放出システムが有用であります。とりわけ、電気刺激による薬物放出が制御できるシステムは近未来型薬物送達システムとして期待が大きいのですが、いまだ有効なシステムは実現しておりません。このような状況から、電気信号(電位や電流)を効果的に化学変化(薬物の放出)へと変換する新しい方法の開発が必要です。そこで我々の研究室では、電極と薬物固定化膜を組み合わせた微小システムを作製し、微弱な電気信号により薬物放出が可能なマイクロチップを開発しています。
イオントフォレシスとは電気エネルギーを利用して主にイオン性薬物の生体膜透過を促進させる方法であります。電極を有する2つのリザバー*を皮膚に貼付し、アニオン性薬物なら陰極槽に、カチオン性薬物なら陽極槽に封入して両リザバーの電源をつなげ、低電圧または低電流を与える。その結果、薬物が皮膚に移行し、同時に、薬物と対をなす内因性イオンが皮膚からリザバー中に抽出される。また、もう一方のリザバーでもイオン交換が引き起こされ、電気回路が成立します。

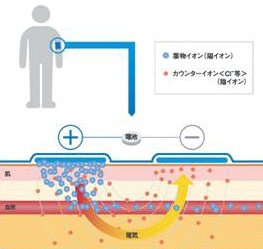
実際、剃毛したマウスの皮膚にBenzoate溶液を含んだ薬物リザバーを貼付し、電流を印加しBenzoateの皮膚透過を検討したところ、電流を印加しない場合と比較して、皮膚透過が促進されることを見出しております。
また、米Isis Biopolymer社により完全にプログラムでき、非侵襲(生体を傷つけない)で、アレルギー誘発性が低く、防水の“Band-Aidのような”パッチを貼るだけで、7日分の投薬の準備が完了するという『The Isis Patch』が開発されています。このパッチは一人一人の患者に向けた設定をすることができます。その結果、医者は従来不可能だったレベルで、個々の患者に固有のプログラムを組むことが可能になります。このパッチは約0.05mm(0.002インチ)の薄い、1枚の柔軟なポリエステル基材上に形成されています。他の経皮パッチとは受動的ではなく能動的である点が異なっています。受動パッチは薬剤を予め充填してあり、皮膚との接触で投与することが出来ます。Isis 社のパッチは投薬の方法に大変革をもたらす可能性もあり、患者、医者、そして医療産業のすべてにメリットをもたらすものと期待されています。


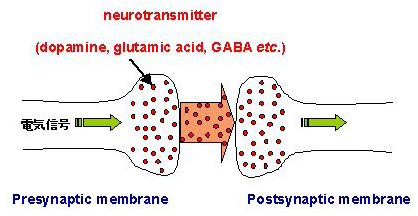
ドーパミン、グルタミン酸、GABAなどの神経伝達物質を化学的に結合させた高分子被服電極を作製し、電気化学的還元反応を利用して、神経伝達物質と高分子との結合部位を開裂させ神経伝達物質を放出させることにより、人工プレシナプスを構築できることを明らかにしています。さらに、ポリピロール膜を被覆したカーボンファイバー電極を用いて電気パルスシュミレーションにより、グルタミン酸のポリピロール膜中への取り込みと放出を繰り返し行うことに成功しています。この人工シナプスの開発は、統合失調症、不安障害、パーキンソン病、うつ病、片頭痛、アルツハイマー型認知症など中枢神経系疾患への応用などが期待されます。

これまでにも、pH変化、熱、浸透圧、光刺激などにより薬物放出を制御するシステムが提案されてきましたが、一長一短があり効果的な薬物放出の実現には至っていません。そこで、イオントフォレシスおよび人工シナプスに関する研究の応用として、電極と薬物固定化膜を組み合わせた微小システムを作製し電気刺激応答型薬物放出制御システムの構築について検討しています。電気信号は、システムを制御するためには理想的な媒体であり、薬物固定化などの工程が成功するならば操作性に優れた理想的な薬物放出システムとなり得ます。
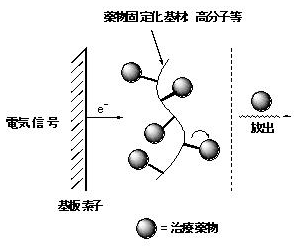

電極との直接反応により薬物を放出することが可能な素子は、基板電極上にナフィオンを被覆した後、表面キャスト法によりカチオン性薬物を静電的相互作用を利用し基板上に固定化することにより作製できます。一方、間接電極反応型の素子は、放出薬物を対イオンとして持つビピリジニウム塩を置換したピロール誘導体を創製し、電気化学的重合反応により基板上へ固定化することにより作製できます。これら作製した素子は、印加電位を制御(クロノアンペロメトリー)することにより、固定されている薬物の放出量を徐放制御することが可能であること明らかにしています。一方、印加電流を制御(クロノポテンシオメトリー)することにより、固定されている薬物の放出量を徐放制御すると同時に、設定電流を微小化にすることにより、固定されている薬物の放出開始を遅延化が可能なことを明らかにしています。

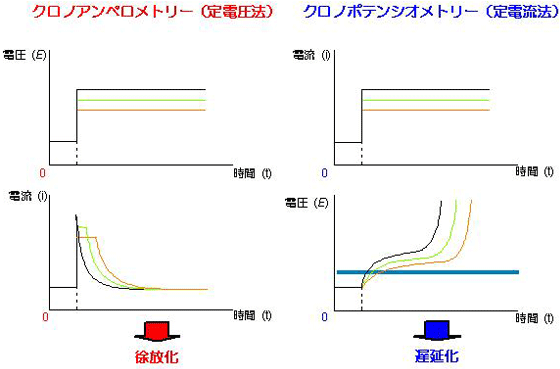
図) クロノアンペロメトリー(左)とクロノポテンシオメトリー(右)による薬物放出制御の概念
最近の薬物送達の展開は、薬物がどこに送達されるかだけでなく、薬物が必要な場所に必要量送達され、患者に対して大きなベネフィットをもたらすことを目指していることから、テーラーメード医療*を指向とした医療現場において電気刺激応答型薬物放出制御マイクロチップを応用した薬物送達システムの適用が広く普及していくものと期待できます。 試作中のマイクロチップのサイズは1.0 cm x 1.0 cm x 0.53 cmであり、薬物貯蔵容量は約150 nlであります。しかしながら、このサイズは体内では異物と判断され、体内から排泄されてしまいます。体内循環型薬物送達マイクロチップの最も適したサイズは200~300nmであることから、現在はマイクロチップの微小化に取り組んでいます。また、マイクロチップにナノサイズの薬物貯蔵庫を多数持たせることにより、体内において長時間周期での薬物送達を可能性にすると共に、種々の疾病用センサを組み込むことで、センサが治療域の電流を感知したとき治療薬を電気的に放出制御させ、マイクロチップがバイオセンサと電気刺激薬物放出システムとで一元化され、薬物のコントロールド・リリースのオートメーション化を目指して研究中であります。さらに、この電気刺激応答型薬物放出制御マイクロチップに細菌がもっている鞭毛を組み込んだナノマシンができれば、自分自身であるいは外から誘導して体内を自由に動き回ることができ、目的とする疾患部位へのターゲッティングが容易となり、夢の薬物送達システムと成り得ます。


図) 薬物送達用マイクロチップ

図) 電気刺激応答型薬物放出制御マイクロチップの薬物放出イメージ
* 用語解説
【リザバー】体内に薬剤を注入する管に接続してカテーテルの端を皮下に埋め込むための器具。
【テーラーメード医療】個人の遺伝子差異に合わせて、投薬や治療を行う技術。